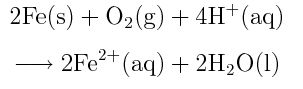réponse simple
Réponse simple :
Il est courant d’observer un dépôt de couleur brun-rouge sur des pièces de fer restées longtemps exposées à l’air et à l’humidité. On appelle ce composé la rouille 1.

Clous rouillés
Ce dépôt est en réalité le résultat d’un lent processus chimique que l’on désigne sous le terme de corrosion. Il s’agit d’un phénomène qui ne se limite pas au cas du fer, il s’applique à un grand nombre de substances selon les conditions du milieu 2.

Tuyau de cuivre corrodé (source)
En ce qui concerne le fer, il réagit spontanément en présence d’eau et d’oxygène pour former de l’oxyde ferrique – le nom chimique de la rouille. Plus l’eau est salée ou acide, plus la réaction est facilité et donc la rouille formée rapidement.

Principe de corrosion du fer et de formation de la rouille
Diverses méthodes existent pour prévenir la corrosion. La solution la plus efficace est de couvrir une partie de la surface à protéger par une couche de zinc : ce dernier étant plus réactif que le fer, il va être complètement dégradé avant que les autres matériaux ne soit attaqués 8.

Pièces de Zinc protégeant la coque d'un bateau (source)
réponse avancée
Réponse avancée :
Il est courant d’observer un dépôt de couleur brun-rouge sur des pièces de fer restées longtemps exposées à l’air et à l’humidité. On appelle ce composé la rouille 1.

Clous rouillés
Ce phénomène, appelé corrosion, ne se limite pas au cas du fer, mais s’applique à un grand nombre de substances selon les conditions du milieu.

Tuyau de cuivre corrodé (source)
La corrosion découle d’un type particulier de réactions chimiques : l’oxydoréduction 2. Il s’agit de réactions mettant en jeu un échange d’électrons entre deux substances : l’un des réactifs, dit réducteur, va céder un certain nombre d’électrons aux profits de l’autre réactif, nommé l’oxydant 3.

L’étude de la corrosion du fer montre que cette réaction nécessite simultanément la présence d’eau et d’oxygène en contact avec la partie métallique. Le mécanisme réactionnel peut être artificiellement décomposé en deux étapes pour faciliter la compréhension.
Étape 1
En premier lieu, le fer solide s’oxyde et libère ainsi des ions Fe 2+ dans l’eau environnante, ainsi que deux électrons qui vont se déplacer dans le métal conducteur :

Dans un milieu légèrement acide (présence de H+ à cause des minéraux de l’eau), l’oxygène de l’air se réduit en captant les électrons libérés par le fer :

En assemblant ces deux demi-réactions qui ne peuvent se dérouler l’une sans l’autre, on obtient la réaction complète de la première étape :
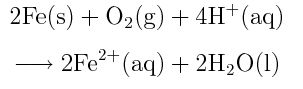
Étape 2
Après cette première étape, les ions en solution Fe 2+ produits par la réaction ci-dessus subissent une seconde oxydation au contact de l’air :

La particularité de cette seconde étape est que les ions Fe3+ précipitent sous forme d’un composé solide, l’oxyde ferrique, qui n’est rien d’autre que de la rouille 4.
La formule complète des deux étapes s'écrit comme suit :

La réaction de corrosion du fer peut donc être illustrée par l'image suivante :
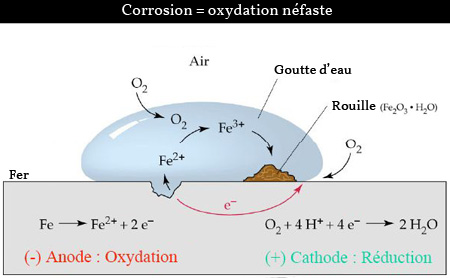
Schémas général de la corrosion du fer (source : PDF cours de chimie pour physicien à l'EPFL - modifiée)
D’un point de vue thermodynamique, l’oxyde ferrique possède une enthalpie standard de formation et une énergie de Gibbs données par :

Enthalpie (en haut) et énergie de Gibbs à 25 °C et 1 bar 5
Comme ces deux valeurs sont négatives, la réaction est spontanée (ne nécessite pas d’apport d’énergie) aux températures et pressions standards, ce qui explique que ce phénomène de rouille soit si courant.
La réaction est toutefois lente d’un point de vue chimique, les effets ne se voient généralement qu’après plusieurs semaines. La présence d’eau salée ou particulièrement acide peut par contre accélérer ce processus, car la conductivité de l’eau est alors accrue et facilite le transfert des électrons 1.
Comme l’oxyde ferrique est un composé de mauvaise qualité (friable, peu conducteur,…), diverses méthodes existent pour prévenir la corrosion. Il peut par exemple être utile de recouvrir d’une couche de peinture la surface que l’on veut protéger 6.
Une solution plus efficace est obtenue en utilisant les propriétés des métaux à son avantage par un biais appelé la protection cathodique 7. Certains matériaux sont en effet plus réactifs que d’autres et vont donc s’oxyder en priorité. En déposant par exemple une couche de Zinc sur une surface en fer (procédé appelé la galvanisation 8), cette dernière ne s’oxydera pas avant que tout le Zinc n’ai réagi et sera donc protégée de la corrosion.

Processus de galvanisation (source : PDF cours de chimie pour physicien à l'EPFL - modifiée)
Il n’est par ailleurs pas obligatoire de recouvrir toute la surface de Zinc, il suffit de déposer certaines pièces, nommées anodes sacrificielles, qui s’oxyderont à la place des parties importantes et qui pourront être facilement remplacées en temps voulu. Cette méthode est fréquemment utilisée pour protéger les coques de bateaux 9.

Anodes sacrificielles sur la coque d'un bateau (source)