réponse simple
Réponse simple :
Lorsque la lumière percute un objet, elle va interagir avec les molécules qui le composent. Une partie des particules lumineuses seront absorbées, d’autres reflétées ou simplement déviées5 : ce comportement donne à nos yeux des indices sur ce qui nous entoure. Nous voyons donc les objets car ils modifient les rayons lumineux qui leur parviennent.

La lumière est bloquée ou déviée par les matériaux (agrandir l'image)
Par exemple, une pomme nous apparaît rouge car elle absorbe en réalité toutes les autres couleurs qui composent la lumière blanche que nous voyons. Seuls les rayons rouges rebondissent et sont ensuite captés par nos yeux.
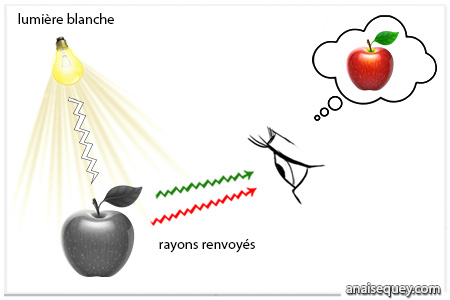
Perception des couleurs (agrandir l'image)

La lumière visible se compose de toutes les couleurs de l'arc-en-ciel (agrandir l'image)
Même un objet qui ne fait que réfléchir les rayons, sans les absorber, peut être visible : c’est par exemple le cas des miroirs.

La surface d'un miroir renvoie la lumière à l'identique (agrandir l'image)
Imaginez à présent un objet qui ne réfléchit pas la lumière et qui ne l’absorbe pas non plus. Autrement dit, les rayons le traversent sans subir de modifications. Notre œil ne voyant pas de différence, il percevra l’objet comme étant transparent.

Nous voyons les rayons provenant de l'autre côté de la vitre (agrandir l'image)

A la fois solide et transparent, le verre est un matériau privilégié pour l'observation (agrandir l'image)
Les exemples de matériaux sont nombreux : vitres, eau, gaz, atmosphère, certains plastiques… tout ce qui laisse passer la lumière visible. Ils peuvent néanmoins absorber d’autres formes de rayonnements, comme les UV et les infrarouges8.

L'atmosphère est transparente, mais elle absorbe d'autres types de rayons (agrandir l'image)
Bien qu’étant transparentes, ces substances peuvent dévier suffisamment les rayons sous certains angles pour que l’on puisse deviner leur présence. Ce processus s’appelle la « réfraction ».

Le cure-dent semble "cassé", car la lumière est déviée à l'interface entre l'air et l'eau (agrandir l'image)
Toutes ces propriétés dépendent de la structure microscopique de la matière : c’est-à-dire de quoi l’objet est composé et comment ces éléments s’agencent7. En modifiant ces données, par exemple en ajoutant des impuretés dans une vitre, on peut changer sa réaction à la lumière et ainsi lui conférer les teintes souhaitées12.

Le verre peut être coloré de multiples façons (agrandir l'image)
Vous souhaitez davantage de précisions ? Lisez l'onglet "réponse avancée" en début d'article.
réponse avancée
Réponse avancée :
La lumière visible constitue une fraction du spectre électromagnétique, qui inclut également d’autres types de rayonnements – comme les infrarouges, les ultraviolets et les micro-ondes1. Toutes ces notions correspondent en réalité au même phénomène physique, à savoir la propagation d’ondes électromagnétiques et le déplacement de particules appelées photons2.
Chaque type de rayonnement est ainsi caractérisé soit par sa longueur d’onde, soit par l’énergie des photons qui le composent. Par exemple, les infrarouges sont constitués de photons moins énergétiques que ceux de la lumière visible, eux-mêmes moins énergétiques que les ultraviolets1.
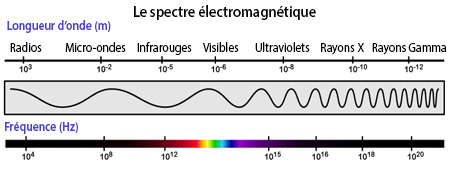
Tous ces types d'ondes relèvent du même phénomène (agrandir l'image) (source modifiée)
Lorsqu’ils se déplacent, les photons vont interagir avec la matière qui nous entoure : ils peuvent être absorbés, réfléchis, ou alors simplement déviés. S’ils font partie du spectre du visible, les modifications qu’ils subissent fournissent des indices à nos yeux. C’est ainsi que nous voyons les objets de notre environnement, d’après leur façon de modifier la lumière qui leur parvient.

Les photons se comportent différemment face aux matériaux ; ce qui créer la diversité visuelle (agrandir l'image)
Par exemple, les feuilles nous apparaissent vertes car elles contiennent de la chlorophylle ; un pigment qui absorbe toutes les autres couleurs du spectre lumineux. Seuls les photons dont la longueur d’onde correspond au vert rebondissent et sont ensuite captés par nos yeux.

Perception de la couleur (schéma issu de sources multiples) (agrandir l'image)

Le spectre du visible se décompose facilement : il est observable dans les arc-en-ciels (agrandir l'image)
Pour comprendre comment les objets interagissent avec la lumière – et par extension l’apparence qu’ils revêtent – il faut savoir comment s’organise la matière au niveau microscopique.
On peut très schématiquement décrire les atomes comme étant formés d’un noyau autour duquel se situent des électrons. Une caractéristique très importante de ces électrons est qu’ils ne peuvent pas avoir n’importe quelle énergie. Par exemple, si l’on considère un atome isolé, les électrons se répartissent selon un modèle de couches, où les plus éloignées du noyau sont les plus énergétiques3.
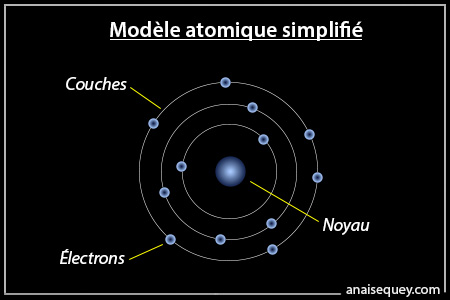
Représentation fictive et (très) simplifiée d'un atome =)
Lorsqu’un photon passe à proximité d’un atome, il va interagir avec les électrons. À ce moment-là, deux principaux cas de figure peuvent se présenter :
- Soit l’énergie du photon correspond à la différence entre deux couches électroniques de l’atome. Dans ce cas il sera absorbé par l’électron, qui va momentanément passer dans une couche supérieure (on dit qu’il est « excité »4).
- Soit l’énergie du photon est trop différente, dans ce cas il ne peut pas être absorbé. Il va « rebondir » et poursuivra son chemin5 ; on parle alors de « diffusion ».

Illustration des processus d'absorption et de diffusion (agrandir l'image)
C’est la nature de l’atome qui définit l’énergie requise pour passer d’une couche à l’autre. En d’autres termes, il en découle que pour un matériau donné, seuls certains rayons spécifiques pourront être absorbés.

Les fines raies noires correspondent aux longueurs d'ondes absorbées (source)
Cette spécificité permet par exemple d’analyser la structure chimique d’une étoile, en étudiant les rayonnements qu’elle renvoie.
Les choses se compliquent dans les matériaux complexes comme le verre, où les interactions moléculaires modifient la disposition naturelle des électrons. Les valeurs d’énergie que ceux-ci peuvent prendre deviennent donc plus étendues et se présentent sous forme de bandes6, séparées par des zones dites « interdites ».
Mais au final, même si les valeurs diffèrent, le processus est le même que pour un atome seul : si l’énergie du photon incident correspond à la différence d’énergie entre deux bandes, alors il sera absorbé et excitera un électron qui va passer dans la bande supérieure7.

Les matériaux complexes absorbent davantage de longueurs d'ondes car leurs électrons sont moins localisés (agrandir l'image)
Dans le cas de la silice vitreuse – un type de verre – l’énergie requise par les électrons pour monter d’une seule bande est de 9 électronvolts8. Or la lumière visible est composée de photons dont l’énergie est comprise entre 1.7 et 3.2 eV, donc insuffisante pour exciter les électrons du solide. C’est pourquoi ce matériau parait transparent à nos yeux : la majorité de la lumière visible le traverse sans être ni absorbée ni réfléchie.
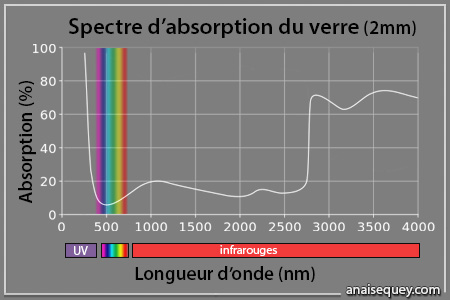
Le verre laisse passer ~ 90% de la lumière visible (agrandir l'image) (schéma fait d'après cette source)
Sur le graphe ci-dessus, on observe que ce sont les ultraviolets (de type B) qui sont suffisamment énergétiques pour être absorbés par le verre. Ces rayons ne peuvent donc pas traverser une vitre.
Il en va de même pour une partie des infrarouges, pourtant moins énergétiques que la lumière visible, mais dans ce cas le mécanisme d’absorption est dû à un autre phénomène. Les atomes peuvent en effet vibrer les uns par rapport aux autres à des fréquences très précises9. Lorsque l’énergie du photon correspond à cette fréquence, il est alors absorbé par la molécule. Les énergies nécessaires à ce genre de phénomène correspondent typiquement à la région infrarouge du spectre électromagnétique.
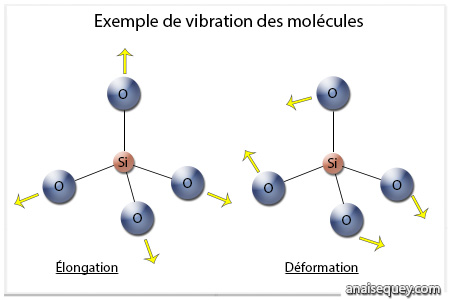
Illustration du processus de vibration moléculaire (agrandir l'image)
La transparence n’est évidemment pas une propriété exclusive au verre ; on la retrouve dans l’eau, la plupart des gaz, ainsi que d’autres matériaux solides comme le Plexiglas et certains plastiques10. Tous ces éléments ont en commun de laisser passer la lumière, bien que l’on puisse deviner leur présence sous certains angles.

Entre des milieux différents, il peut se produire une réfraction de la lumière (agrandir l'image)

Réflexion partielle d'une vitre dans des conditions de faible luminosité (agrandir l'image)
À l’opposé, tous les types de « verres » ne sont pas transparents à la lumière visible. Par exemple les verres de chalcogénure peuvent absorber les rayonnements à partir de 1 eV et nous apparaissent donc opaques8 et 11.

Verres de chalcogénure (source)
Notons qu’il est facile de modifier la structure chimique de ces matériaux transparents pour changer leur réactivité à la lumière. En ajoutant par exemple des impuretés spécifiques dans le verre, on peut lui conférer la couleur de notre choix12.

L'oxyde de chrome permet de teindre les bouteilles en vert (agrandir l'image)





















Commentaires
C’est en effet l’une des difficultés de la vulgarisation de demander des omissions et des simplifications. À mon avis ce n’est pas un problème du moment que ces limites sont clairement présentées comme telles. Je trouve que c’est le cas dans cet article, car il est bien mentionné que le modèle atomique était volontairement simplifié. Je reconnais par contre que le terme « gravite » pourrait porter à confusion, vu qu’il fait référence à la force de gravitation qui est bien sûr complétement négligeable comparée à l’interaction électrique proton-électron.
Selon moi le danger apparaît lorsque le vulgarisateur ne dit pas que sa description est simplifiée, car les lecteurs risquent de prendre ses explications pour acquises. C’est d’ailleurs un problème qui n’est pas restreint à la vulgarisation et qui se retrouve par exemple dans le milieu scientifique. Étant physicien, je réalise au quotidien que l’un des défis majeurs de la description d’un phénomène est d’établir des approximations. A strictement parler, je suis constamment réduis à faire des "erreurs" dans le sens où je n’obtiendrai jamais une description parfaite de la réalité. Il est néanmoins crucial d’avoir à l’esprit ces simplifications, d’en tenir compte et d’essayer de les améliorer, car sans cela on risque d’oublier que l’on travaille sur des approximations.
Bonjour,
Oui bien sûr, rassurez-vous je ne vois pas les électrons comme des balles de ping-pong qui gravitent autour d’un mini-soleil
Cela dit ça ne me dérange pas de remanier encore un peu les phrases pour insister sur l’irréalisme de cette simplification (et notamment remplacer « gravitent », qui peut prêter à confusion), mais au-delà de ça je ne pourrai pas intégrer les bases de la mécanique quantique dans un article qui ne fait qu’effleurer le sujet. D’ailleurs, je dois admettre que malgré les faits établis, la description probabiliste du mouvement d’un électron par sa fonction d’onde ne me paraît pas forcément si conforme à la réalité…… Mais à ce niveau-là j’ai bien conscience que ça ne peut rester qu’un avis très personnel.
Bonne suite à vous de même et merci d’avoir pris le temps d’écrire cette rectification.
Attention: à vouloir schématiser les choses, on simplifie trop et on dit involontairement une erreur.
Autour du noyau dans un atome, les électrons ne "gravitent" pas. A ces échelles, il n'y a pas de trajectoire au sens où nous l'entendons pour les objets de notre quotidien. Les électrons sont bien présents autour du noyau et organisés en couches. Mais les cercles qui se voudraient abusivement décrire leur mouvement autour du noyau - circulaire ou pas - sur un schéma dessiné à la main est un abus toléré (une première erreur) qui ne saurait être complétée par le terme "gravitent", ou bien "tournent", ou bien se "déplacent autour", ou "orbitent" (une seconde erreur). Pour simplifier, disons que, si l'on pouvait voir à ces échelles - en zoomant -, on ne pourrait pas 'suivre des yeux' les électrons, de même que les composants du noyaux. On verrait une zone plus ou moins floue pour chaque électron, indiquant les chances qu'il a de se trouver à cet endroit. ;)
Cela dit, mise à part ce détail, tout de même important, excellent article. Continuez ;)
Cordialement,
F.M.