Action du vinaigre sur un oeuf cru
Détail de l'expérience :
Sommaire
- Immersion de l'oeuf
- Dissolution de la coquille (couche externe)
- Dissolution de la coquille (couche interne)
- Manipulations
- Osmose
- Comparaison des oeufs
- Jour 1 : 23 août 2011 (sommaire)
Je remplis un grand bocal de vinaigre blanc (45% d'acide acétique).
Une grande quantité de vinaigre est nécessaire afin de couvrir entièrement l'oeuf
J'y ajoute délicatement un oeuf de poule cru, dont la taille initiale vaut environ 5.5 cm. L'oeuf est immergé avec le gros bout vers le haut afin que la poche d'air le maintienne vertical.
Un oeuf de poule standard
L'oeuf coule en premier lieu, mais après deux minutes il remonte à la surface, poussé par les bulles de gaz qui se forment sur la coquille. Il suffit alors d'agiter un peu le bocal pour que les bulles s'échappent et que l'oeuf retombe au fond.
De petites bulles se forment sur la coquille
Deux minutes après l'immersion, l'oeuf se met à flotter (© IS)
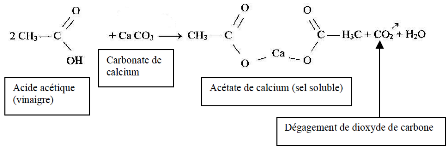
Le gaz dégagé est en réalité du dioxyde de carbone produit par la réaction acido-basique entre le vinaigre et le carbonate de calcium (calcaire) contenu dans la coquille.
Réaction entre l'acide acétique et le CaCO3 (agrandir l'image) (source)
Les bulles s'agglutinent à la surface du liquide et forment une sorte d'anneau de mousse.
Le gaz s'échappe et s'accumule en surface
Deux heures plus tard, la partie externe de la coquille (sorte de film fin) commence à s'enlever, laissant voir une couche blanchâtre.
La coquille se dégrade
Je laisse la réaction se poursuivre durant la nuit.
- Jour 2 : 24 août 2011 (sommaire)
Tôt dans la matinée, douze heures exactement après le début de l'expérience, la "peau" de la coquille est presque totalement dissociée du reste.
Le film supérieur se sépare de la partie inférieure
J'attends encore trois heures et demi pour voir la progression, puis je sors l'oeuf pour en vérifier l'état.
La couche s'est entièrement enlevée
L'oeuf est mou. Je le rince à l'eau pour prendre des photos.
Il reste des fragments de couche supérieure
La partie inférieure de la coquille n'a pas encore été dissoute. Elle semble plus épaisse et sa texture est friable (crayeuse).
Une heure plus tard, soit environ 16h30 après l'immersion, la couche inférieure de la coquille commence à se dissoudre et laisse entrevoir l'intérieur de l'oeuf (protégé par une fine membrane semi transparente).
Sous la couche blanche on peut voir le jaune interne
L'oeuf n'est pas cuit : l'intérieur est encore liquide et le jaune s'y déplace librement.
L'oeuf est toujours cru (© IS)
On voit que l'oeuf a pris un demi centimètre de longueur, ce qui peut être dû à l'osmose, phénomène que je testerai plus tard.
La texture de l'oeuf est à la fois molle et élastique. Il rebondit alors facilement.
L'oeuf rebondit(© IS)
Je place à présent un second oeuf dans un autre verre de vinaigre afin de disposer de deux éléments. Je laisse poser ces deux oeufs jusqu'au matin suivant afin que tous les restes de coquille soient enlevés.
- Jour 3 : 25 août 2011 (sommaire)
Les oeufs sont à présent complètement à nu, sauf bien sûr la fine membrane qui les entoure.
Les deux oeufs sont totalement débarrassés de leur coque
Je place donc le premier dans un bocal contenant de l'eau.
L'oeuf est immergé dans l'eau
Puis je mets le second dans un verre de sirop lichee non dilué. Je pose un objet lourd sur l'oeuf pour qu'il coule malgré la densité du liquide.
J'ai choisi un sirop assez clair pour pouvoir suivre l'évolution dans le verre
L'oeuf flotte
Si tout se déroule correctement, le premier oeuf devrait se gorger d'eau et l'autre se vider de son eau.
Il s'agit d'un simple phénomène d'osmose : la membrane entourant les oeufs laisse passer l'eau, mais pas les autres substances. L'eau étant attirée par les sels (= sel, sucre, ou autres), elle traverse naturellement la membrane pour se diriger vers l'endroit où ces éléments sont le plus présents.
Dans le premier cas, l'intérieur de l'oeuf dispose de plus de sels que l'extérieur, c'est donc l'eau du bocal qui va rentrer dans l'oeuf. Dans le second cas, le sirop est très concentré en sucre (500g/l), c'est donc l'eau de l'oeuf qui va sortir dans le verre.
En regardant de près le verre de sirop, j'aperçois de petites ondulations à la surface de la coquille ; probablement l'eau qui s'échappe de la membrane.
Une demi-journée plus tard, je sors les deux oeufs de leur récipient respectif.
Le premier est en haut
On voit une grande différence de taille, de teinte et de texture. Le second oeuf est clairement plus petit et flasque : la membrane forme de larges plis lorsqu'on la touche, alors qu'elle est rebondie dans le cas du premier oeuf. La pression interne a donc changé dans les deux cas.
Comparaison et ouverture accidentelle du premier oeuf (© IS)
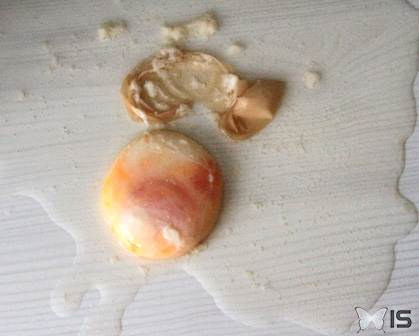
Comme je ne peux pas expliquer la différence de teinte, je décide d'ouvrir les deux oeufs afin de constater les différences internes.
J'enlève la membrane protectrice
Concernant le premier oeuf :
- il contient d'avantage d'eau
- le jaune et une partie du blanc semblent "pochés"
- le jaune et le blanc sont plutôt liquides
- quelques morceaux de blanc sont agglomérés
Intérieur du premier oeuf
Une sorte de membrane s'est formée (© IS)
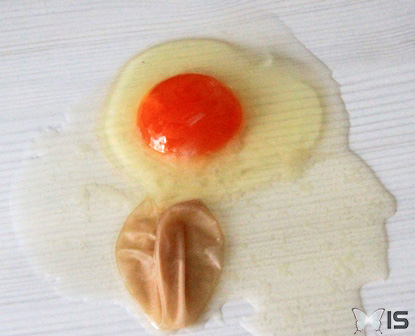
Concernant le deuxième oeuf :
- il ne contient presque pas d'eau
- le jaune est solide et le blanc moyennement ferme.
- le jaune et le blanc ne sont pas pochés
Intérieur du second oeuf
Le jaune est solide(© IS)
Je ne saurais pas m'expliquer certaines de ces différences, elles peuvent être dues à de nombreux facteurs. Il faudrait réaliser à nouveau l'expérience avec un timing plus rigoureux pour en tirer des conclusions fiables.
N'hésitez pas à me transmettre vos résultats et/ou explications pour pouvoir écrire un bilan clair.
--> Retour à la présentation <--
--> Voir les informations pratiques <--




















Commentaires
J'aimerais savoir si il s'agit d'une transformation chimique ou non.
Merci
Bonjour,
Effectivement je l'ai conservé au frais dans un récipient et j'ai l'impression qu'il continue à se ramollir.Je vous tiendrais au courant pour la durée de la consevration.
Merci.
Bonjour,
J'ai utilisé les miens pour faire des expériences d'osmose, je ne sais donc pas combien de temps ils auraient tenus. Ce sera à vous de nous le dire
Si j'étais vous, je le mettrais dans un bol, on ne sait jamais...