Acidité, pH et indicateurs colorés
Détail de l'expérience :
Sommaire
- Brèves explications sur l'acidité et le pH
- Mesure du pH d'une liste de produits
- Informations sur les indicateurs colorés
- Expérience du jus de chou rouge
- Jour 1 : 13 janvier 2012 (sommaire)
Bien que l'acidité d'une substance soit intuitivement présente dans l'alimentation, il existe une définition chimique qui repose sur les propriétés de la matière. Nous avons mis en place l'expérience suivante pour illustrer brièvement cette notion d'acidité.
Scientifiquement parlant, un produit est dit acide lorsqu'il peut libérer des protons (ions H+), de manière directe ou indirecte. A l'inverse, si une substance peut capter des protons, elle est alors dite basique.
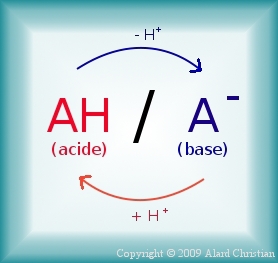
Les acides et les bases sont complémentaires (source)
En mesurant le nombre de protons à l'état libre dans un liquide, il est alors possible de savoir si le produit en question est plutôt acide ou basique. La valeur caractérisant ce nombre est appelée le pH (potentiel Hydrogène). On peut ainsi établir une échelle d'acidité permettant de classer tous les produits existant d'après leur pH : plus cette valeur est basse, plus la substance est acide et plus elle est haute, plus elle devient basique.
Pour des questions mathématiques, cette échelle commence à 0 (acidité maximale) et s'achève à 14 (basicité maximale). A exactement 7, on considère que le produit est neutre.
![Échelle colorimétrique du pH Le pH correspond au logarithme de la concentration de protons (-log[H+])](/images/stories/observations/pH.jpg)
Le pH correspond au logarithme de la concentration de protons (-log[H+]) (source)
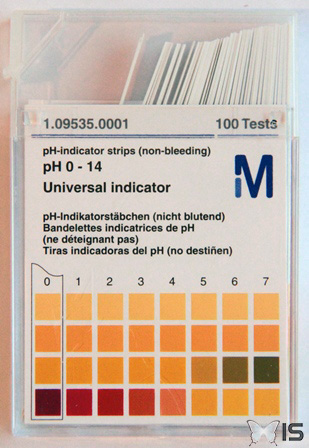
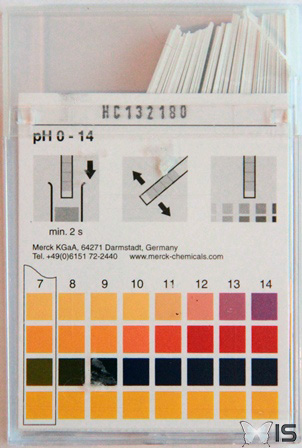
De nos jours, différents moyens ont été mis en oeuvre pour mesurer facilement le pH sans avoir à passer par des formules ; il existe des appareils électriques, mais également des bandelettes qui changent de couleurs d'après l'acidité de la substance.
Bandelette dans sa teinte originelle
Les bandelettes changent de couleur après avoir été imbibées de la substance à tester
Les indications permettent de reconnaitre à quel pH correspondent les couleurs obtenues
Lorsqu'une base est mélangée à un acide, par exemple de l'eau de javel (basique) avec du jus de citron (acide), le pH de la solution totale va alors se stabiliser entre les deux extrêmes. Lorsque la puissance et le volume de l'acide compense exactement ceux de la base, le pH devient alors neutre, à 7.
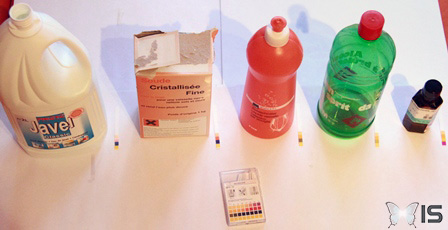
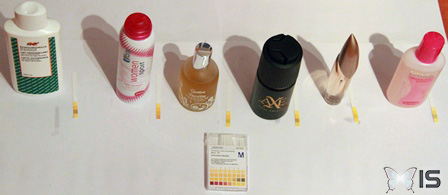
Pour débuter concrètement notre expérience, nous commençons par mesurer le pH d'une quarantaine de substances communes (boissons, nettoyants et cosmétiques) afin de donner d'avantage de réalité à ces notions d'acidité.
! Ces mesures sont effectuées à titre indicatif, elles comportent une certaine imprécision et les valeurs trouvées peuvent notamment dépendre de la marque des produits.
Boissons
Boissons et aliments liquides :
Rappel : la salive a un pH de 7,5 et l'acide gastrique de 2.
- Eau gazeuse : pH = 6
- Eau du robinet : pH = 7.2
- Eau minérale : pH = 7.5
- Eau distillée :pH = 7
- Jus d'orange : pH = 4
- Jus de poire : pH = 4
- Jus de pomme : pH = 3.2
- Jus de citron : pH = 1.8
- Thé froid (Nestea) : pH = 3.5
- Sirop grenadine (dilué) : pH = 3.5
- Sirop citron (dilué) : pH = 3.2
- Coca : pH = 2.5
- Vin rouge (de cuisine) : pH = 3
- Vinaigre aux herbes (45g/L) : pH = 2.2 (les calculs nous donnent 2,45)
- Huile d'olive : pH = 5
- Vin blanc (de cuisine) : pH = 3.5
- Yogourt à boire (actimel, lait fermenté) : pH = 4.5
- Lait (drink, ouvert le jour même) : pH = 6.7
- Chocolat chaud (brun) : pH = 6.7
- Chocolat chaud (blanc) : pH = 6.7
- Café (soluble) : pH = 5
- Tisane : pH = 6.5
- Thé noir : pH = 7
On remarque que ces boissons sont pratiquement toutes acides.
La luminosité étant à présent trop faible pour obtenir des clichés corrects, je décide de continuer l'expérience le lendemain.
- Jour 2 : 14 janvier 2012 (sommaire)
Jusqu'à présent, nous avons utilisé des bandelettes colorées pour évaluer le pH. Celles-ci sont constituées d'un mélange de différents produits dont la couleur change selon l'acidité. La bandelette résultante est un indicateur coloré dit universel, car elle permet de mesurer toutes les variations de pH de 0 à 14.
Les indicateurs colorés universels couvrent toute l'échelle de pH
Il existe cependant un grand nombre d'indicateurs colorés non-universels qui changent de couleur uniquement dans une certaine gamme de pH. La phénolphtaléine par exemple, un produit bien connu des étudiants et laborantins, passe de transparent à violet lorsque le pH dépasse 8.
L'eau devient basique (seconde partie avec phénolphtaléine) (© IS)
Ces indicateurs sont utiles pour observer une modification spécifique, située dans une gamme précise de pH.
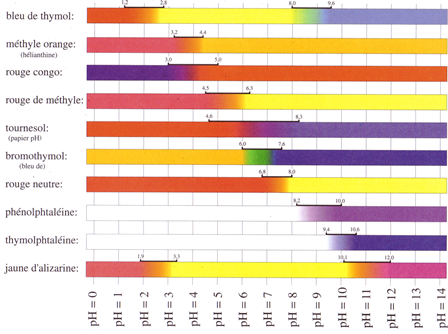
Principaux indicateurs colorés selon leur zone de virage (source : Formulaires et tables p.215)
Outre ces indicateurs officiels, d'autres substances réagissent aux variations de pH. Le jus de chou rouge en est l'exemple le plus courant, nous allons donc en illustrer les propriétés. Nous commençons par faire bouillir des morceaux de chou rouge dans une grande casserole.
Le chou est coupé et mis à cuire
Après quelques minutes, les parois cellulaires se brisent et libèrent le pigment dans l'eau. On obtient donc du jus qui, étonnamment, n'est pas rouge mais bleu à un pH neutre.
Mélangé à l'eau, le pigment est bleu
Nous récoltons ensuite ce liquide dans une grande carafe en ôtant les morceaux de chou à l'aide d'un filtre à thé.
Le jus parait rouge sombre dans un tel volume
Après cela, nous remplissons deux verres avec ce jus de manière à pouvoir distinguer les variations de couleurs.
Le liquide est transféré dans les verres
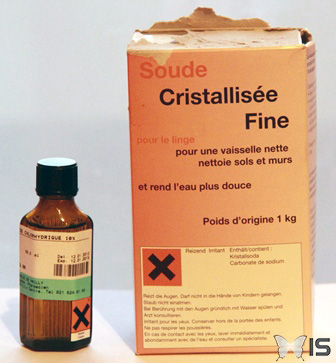
Pour cette expérience, nous choisissons d'ajouter de l'acide chlorhydrique (acide fort, pH = 1) et de la soude (base forte, pH = 11).
Les deux produits sont aux extrémités de l'échelle de pH
Nous mélangeons donc quelques gouttes d'acide dans le premier verre et plaçons un cristal de soude dans le second. Les jus changent drastiquement de couleur, rouge pour le premier et vert pour le second.
Les couleurs finales sont très différentes (l'acide est à gauche)
Le changement de couleur est assez rapide (© IS)
Il serait possible d'obtenir d'autres teintes en faisant varier le pH de manière moins abrupte, mais pour des raisons techniques nous choisissons de ne présenter que ces deux situations.
Pour observer plus en détail le moment où la couleur change, je place le jus restant dans une longue et fine bouteille, dans laquelle j'ajoute ensuite l'acide sans mélanger. Les variations de teinte sont progressives et clairement visibles.
Vidéo accélérée 2x (© IS)
En dernier lieu, nous essayons de réaliser cette même expérience avec d'autres substances (notamment le vin rouge), mais sans résultat probant. Seul le thé noir fait preuve d'une certaine variabilité, mais elle reste nettement inférieure au jus de chou rouge et aux indicateurs "officiels".
Le thé réagit légèrement aux changements de pH (© IS)
--> Retour à la présentation <--
--> Voir les informations pratiques <--

















Commentaires